Ключова разлика: Атомната маса е просто масата на специфичен изотоп или комбинираната маса на атомите, протоните, неутроните и електроните. Атомният номер е броят на протоните, които се намират в ядрото на елемент.
Нека се сблъскаме с това, че химията е объркваща, различното количество елементи, атомни номера, връзки, маса, тегло, атоми и т.н. Атомната маса и атомният номер са две от тези думи, които често се бъркат и използват взаимозаменяемо.
Атомната маса е масата на атома, когато е в покой. Това е така, защото когато един атом се движи с много висока скорост, той има тенденция да се увеличава в масата. Въпреки че според дефиницията, атомната маса е масата на всички протони, неутрони и електрони, електроните са твърде малки, за да направят значителна разлика в атомната маса. Повечето от елементите на периодичната таблица имат изотопи и поради разликата в броя на неутроните, масата на всеки изотоп също се променя.
Атомната маса се изразява като се използват единици атомна маса или amu. Една атомна маса е равна на 1/12 от масата на въглерод-12. Когато масата на един атом се раздели на 1/12 от масата на въглерод-12, се получава относителната маса на елемента. Относителната маса на даден обект обаче е всъщност атомното тегло на даден елемент, тъй като се изчислява чрез разглеждане на всички изотопи. Въпреки това, това не трябва да се приема като атомна маса на даден елемент.

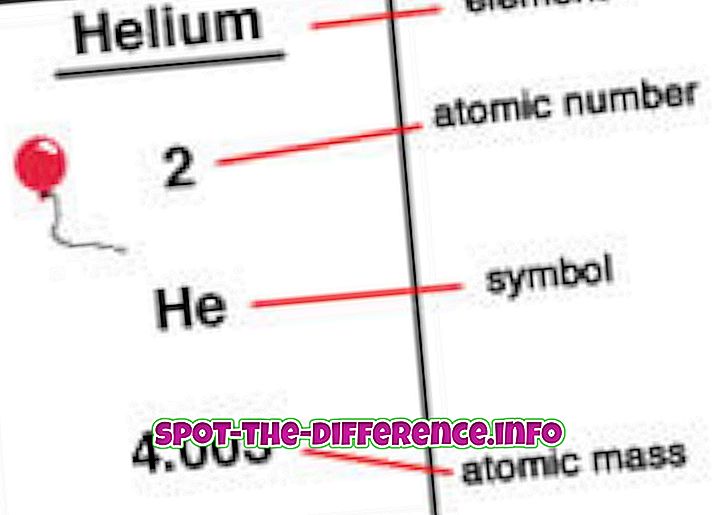
Атомният номер е броят на протоните, които се намират в ядрото на елемент. Когато един атом е неутрален, това означава, че той има същия брой протони и електрони. Атомният номер се обозначава с Z. Тъй като всеки елемент има различен брой протони, този номер се използва и за представяне на елемент. Изотопите обикновено споделят един и същ атомен номер, но се класифицират като се използва тяхната атомна маса, например Carbon-12, Carbon-13.
Елементите се поставят по ред на атомния номер в периодичната таблица. Атомният номер е посочен в горния ляв ъгъл на елемента като горен индекс. Атомните номера могат да помогнат за разкриване на информация за елемента и много хора могат да видят атомния номер и да посочат какъв елемент е той. Той също така показва къде в периодичната таблица може да бъде поставен и дали е течен, газов или твърд. Атомният номер също дава информация за заряда на ядрото, окислителните състояния, поведението на свързване, заряда на йона и др.